Kunnen we gepersonaliseerde zorg gebruiken bij de behandeling van parodontale problemen?
De traditionele manier om ziekte te behandelen is niet-gepersonaliseerd. Onze huidige methode is evidence based. Deze is gebaseerd op gerandomiseerde klinische onderzoeken. Gepersonaliseerde zorg is precies het tegenovergestelde van de evidence based methode. Prof. Mariano Sanz vertelde tijdens zijn online lezing over de vraag of we gepersonaliseerde zorg bij parodontale problemen kunnen inzetten.
De eerste vraag die we hiervoor moeten beantwoorden is: ‘Wat is de gepersonaliseerde zorg?’
De traditionele manier om ziekte te behandelen is niet-gepersonaliseerd. Onze huidige methode is evidence based. Deze is gebaseerd op gerandomiseerde klinische onderzoeken, waarbij gerandomiseerd al aangeeft dat het niet gepersonaliseerd is. Middels de randomisatie worden juist de verschillen binnen een populatie gemaskeerd. Binnen deze studies wordt gekeken naar de effectiviteit van een behandeling op de gehele groep. Waarbij er dus vanuit gegaan wordt dat de behandeling hetzelfde effect heeft op alle personen van deze groep.
Gepersonaliseerde zorg is precies het tegenovergestelde van de evidence based methode.
Preventie
Preventie kan ook gepersonaliseerd worden. Hierbij willen we in een vroeg stadium de personen opsporen die vatbaar zijn voor een aandoening, voordat er sprake is van enige ziekte. Risicofactoren kunnen helpen deze personen op te sporen.
Diagnose
Het tweede aspect is het stellen van de diagnose. Hierbij moet bepaald worden wat deze persoon uniek maakt. Hierop kan de behandeling aangepast worden. Het stellen van de diagnose en bepalen van de juiste behandeling is sterk met elkaar verbonden.
Etiologische factoren en risicofactoren
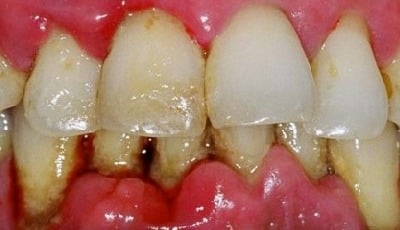
Voor het bepalen van etiologische factoren en risicofactoren, is het van belang om te begrijpen hoe parodontitis zich ontwikkelt. Één van de manieren om parodontitis gepersonaliseerd te benaderen is door de samenstelling het microbioom van een patiënt te analyseren en hierop de behandeling te baseren. Het probleem van het bestuderen van het microbioom is dat we heel veel verschillende bacteriën vinden in de mond, waarvan we de rol en etiologie nog niet volledig kennen. Het hele microbioom is veel complexer dan we vroeger dachten.
Er zijn een aantal genetische risicofactoren bekend. In 1997 vonden we een interleukine-1beta genotype wat het risico op het ontstaan van parodontitis leek te verhogen. Helaas was slechts één afwijkend genotype niet voldoende om de vatbaarheid voor parodontitis te verklaren. Tegenwoordig hebben we de technologie om naar het hele genoom te kijken om hierbinnen genetische risicofactoren op te sporen. In een recent onderzoek werden acht risicogenen geïdentificeerd met een suggestieve associatie met vatbaarheid voor parodontitis.
Er zijn andere ziektes, zoals borstkanker, waarbij er een hogere polygene risico score is. Deze is samengesteld uit zowel genetische markers als de familiegeschiedenis en de klinische historie. Bij borstkanker kunnen we aan de hand van genetisch informatie redelijk goed bepalen of iemand een groter risico heeft op het krijgen van borstkanker. Bij parodontitis hebben we nog niet zo’n score. Bij de pathogenese van parodontitis lijkt de heftigheid van de ontstekingsreactie belangrijker dan de samenstelling van de biofilm.
Biomarkers zijn veelbelovende stofjes die ons een aanwijzingen geven dat de ziekte aan het ontstaan is, voordat de klinische symptomen zichtbaar zijn. Voorbeelden van biomarkers zijn MMP-8, IL-1b, ICTP. Vandaag de dag hebben we nog niet voldoende informatie om een gepersonaliseerde aanpak te maken aan de hand van deze biomarkers. Het is nodig om een combinatie te maken tussen deze biomarkers. Hiervoor is waarschijnlijk een algoritme nodig om alle informatie te bundelen.
De nieuwe classificatie
We hebben recent een nieuwe classificatie gekregen voor de behandeling van parodontitis met daarbij een nieuw stapsgewijs behandelprotocol. Dit protocol is nog steeds evidence based.
Aan de hand van de classificatie proberen we de behandeling wel meer gepersonaliseerd te maken. Er is op dit moment geen bewijs dat biomarkers kunnen helpen een meer gepersonaliseerde aanpak te creëren. Daarom is de mate van progressie leidend geworden in het opdelen van de patiënten. Dit maakt het individualiseren makkelijker. In de toekomst kunnen we met behulp van ‘big data acquisition’ en algoritmes nog verder personaliseren. Hiervoor hebben we klinische en radiologische informatie nodig die we samen voegen. Een voorbeeld waarbij al in enige mate gepersonaliseerd wordt, is bij het bepalen van de nazorg termijn. Hierbij wordt onderscheid gemaakt in een hoog, gemiddeld en laag risico met de daarbij behorende nazorg periode.
Niet alleen onze manier van benaderen verandert, ook de patiënt verandert. Vroeger werd de patiënt met name door de professional van informatie voorzien, maar tegenwoordig zijn ze veel meer actief betrokken. Ze zoeken zelf informatie op het internet en zijn actief betrokken bij de behandeling.
Gepersonaliseerde zorg voor de behandeling van kanker
Tegenwoordig kunnen we zeer gerichte therapie voor kankercellen toepassen. Hierbij richt het medicijn zich op eiwitten op de celwand van de kankercel om ze op te sporen en te vernietigen. Helaas zijn deze eiwitten zijn soms ook aanwezig op de celwand van gezonde cellen. Er zullen hierbij dus ook eigen cellen aangevallen en opgeruimd worden met de daar bijbehorende bijwerkingen. Deze therapie is gepersonaliseerd: het is aangepast op het soort kankercel. Helaas is deze alleen niet precies genoeg, want ook onze eigen cellen worden vernietigd. Tegenwoordig is het mogelijk bij de behandeling van leukemie om de eigen cellen zo te modificeren dat zij het specifieke eiwit niet meer op hun celwand tot expressie brengen, waardoor de behandeling veel preciezer is en er minder bijwerkingen zijn.
Meer informatie nodig
Om goede algoritmes te maken voor gepersonaliseerde zorg is er meer informatie nodig. En niet zoals nu alleen informatie uit de universiteitsklinieken, maar juist ook informatie uit de reguliere praktijk.
Prof. Mariano Sanz is hoofd Parodontologie aan de Universiteit Complutense in Madrid. Ook is hij werkzaam bij de faculteit Odontologie aan de Universiteit van Oslo.
Verslag van de lezing van Prof dr. Mariano Sanz door Paulien Buijs, tandarts, tijdens de EuroPerio Series Single Session van de EFP.